
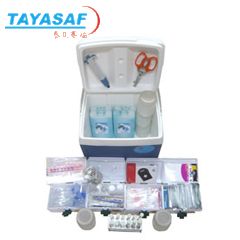
游泳池水质微生物采样检测箱
| 订货号: | MM-15649-00 |
| 产地: | 中国 |
| 品牌: | |
| 开发编号: | N |
| 市场价: | ¥ |
| *此产品根据配置不同价格不同 |
| *此价格为参考价格,具体价格以订单合同为准 |
- 我在现场:
- 产品视频:

- 产品描述
- 技术参数
- 技术文档
- 相关产品
- 明细价格
- 购买流程
产品描述:
概述
游泳池水质的控制、监测与处理,对防止传播疾病和保障游泳者的健康和安全发挥重要的作用。要求池水的感官性状良好,水中不含有病原微生物,水中所含化学物质不得危害人体健康,保证游泳池水水质的安全、可靠。
水质卫生的现场常规检测由各游泳场馆负责游泳池水质的现场常规检测,开放时间内应每隔2h检测一次。各游泳场馆应配备专门水质管理员。采样点50m比赛游泳池至少6个,25m训练池至少4个。
我国和相邻国家及地区的泳池水质指标大大落后于国际先进水平,而国外的标准也在提高。近几年,在编制新“游泳池水平标准”时,我国与国际的差距正在不断缩小,各项泳池水质指标均力求与国际水平接轨,对游泳池水质的检测力度也在不断加强。
技术参数:
.jpg)
.jpg)





泰亚赛福作为众多知名品牌的合作伙伴,优惠的价格+完善的售后服务体系向您提供产品。font>
游泳池水质常规检验项目及限值
中华人民共和国国家标GB 9667─1996
|
池水温度 |
22~26℃ |
|
pH |
6.8~8.5 |
|
浑浊度 |
≤ 5 NTU |
|
尿素 |
≤ 3.5 mg/L |
|
游离性余氯 |
0.3 ~0.5 mg/L |
|
化合性余氯 |
≤0.4 mg/L |
|
菌落总数 |
(36℃+1℃,48h) ≤1000 个/mL |
|
总大肠菌群 |
(36℃+1℃,24h) ≤18个/L |
.jpg)
.jpg)
适用于游泳池水中菌落总数和总大肠菌群检测
标准配置
|
品名 |
规 格 |
单位 |
数量 | ||
|
双层注塑箱体含蓝冰 |
400×310×380mm |
个 |
1 | ||
|
紫外线消毒灯 |
便携式 |
台 |
1 | ||
|
水质采样器 |
250ml采样量 |
套 |
1 | ||
|
水质采样器 |
30ml采样量 |
套 |
1 | ||
|
采样罐 |
250ml |
个 |
4 | ||
|
采样罐 |
30ml |
个 |
10 | ||
|
采样罐 |
15ml |
个 |
12 | ||
|
7号采样袋 200×140mm |
50个/包 |
包 |
1 | ||
|
3号采样袋 100×70mm |
100个/包 |
包 |
1 | ||
|
无菌样品袋 240×170mm |
10个/包 |
包 |
5 | ||
|
无菌注射器 |
5ml |
支 |
5 | ||
|
一次性采样手套 |
100只 |
包 |
1 | ||
|
一次性吸管 3ml |
30只/包 |
包 |
1 | ||
|
接种棒和接种针 |
|
套 |
1 | ||
|
手动可调式移液器1.0~5.0ml |
720110型 |
支 |
1 | ||
|
移液嘴 1.0~5.0ml |
20只/袋 |
袋 |
1 | ||
|
防泄漏酒精灯 |
金属材质 |
个 |
1 | ||
|
酒精瓶 |
自备酒精 |
个 |
1 | ||
|
酒精瓶 |
自备75%酒精 |
个 |
1 | ||
|
消毒棉球 |
50克 |
包 |
1 | ||
|
镊子 |
不锈钢 |
把 |
2 | ||
|
多功能剪刀 |
不锈钢 |
把 |
1 | ||
|
长柄大号棉签 |
50只/包 |
包 |
1 | ||
|
不锈钢试管架 |
12孔 |
个 |
1 | ||
|
标签纸 |
|
袋 |
1 | ||
|
记号笔 |
普通型 |
支 |
2 | ||
|
塑料储物盒 |
175*130*110mm |
个 |
2 | ||
|
菌落总数测试片 |
24片/包 |
包 |
2 | ||
|
水质总大肠菌群检测试剂盒 |
10份/盒 |
盒 |
1 | ||
|
水源水大肠菌群检测纸片(15片法) |
1份/包 |
包 |
4 | ||
可选配置
大肠埃希氏菌和耐热大肠菌群测试片
水质大肠菌群检测试剂盒
水质大肠菌群检测纸片
菌落总数测试片
水质尿素速测管
水质氨氮速测管
水质总硬度快速检测试剂盒
水质余氯与总氯速测盒
水质色度速测标准管
采样罐 水质采样器
笔式酸度计 温度计
便携培养箱
培养箱

水质总大肠菌群检测试剂盒使用说明
1.适用范围:适用于二次供水、自来水、水源水、生活饮用水、矿泉水等样品中总大肠菌群检测。对污染较严重的样品采用十五管法,其它可采用五管检测法。
2.方法原理:与国标法相同。事先将乳糖蛋白胨培养基双料、乳糖蛋白胨培养基单料浓缩至试剂盒培养孔中,随时取用。
3.操作方法:
3.1十五管法:用无菌吸管吸取5个10mL水样分别加入到试剂盒1号~5号5个大发酵培养基孔内。吸取5个1mL水样分别加入到试剂盒7号~11号5个小发酵培养基孔内。吸取5个用灭菌生理盐水稀释后的1:10稀释液1mL加入到试剂盒12号~16号小发酵培养基孔内。余孔可做对照。
3.2 五管法: 用无菌吸管吸取5个10mL水样分别加入到试剂盒1号~5号5个大发酵培养基管(孔)内。余孔可做对照。
3.3 排气泡: 加样后集气窗内如有气泡存在,可将试剂盒以30~45度角倾斜使气泡排出,必要时可轻轻用力在桌面上敲击数次排出气泡。
3.4 培养:将加样后的试剂盒置36℃± 1℃温箱中,培养18h~24h。
3.5 观察结果:样液变为黄色为产酸、集气窗中有气泡为产气,产酸产气者为阳性结果,可根据试剂盒的阳性管数,参照国标GB/T5750.12-2006的方法,查表 MPN检索表(表2或 表3),报告每100mL水样中的总大肠菌群最可能数。如需对阳性结果进一步证实,可参考GB/T5750.12-2006方法进行。如所有管数均为阴性时,可报告总大肠菌群未检出。
4. 注意事项:
4.1加入样品后不需摇匀,平拿平放。
4.2 加样时可用一次性无菌塑料吸管,将样品稀释液加至试剂盒所标刻度处。
4.3 在培养箱中取试剂盒时应平托出来,不要倾斜以免由于试剂盒的倾斜将阳性管集气窗中的气泡排出而影响结果。
4.4 试剂盒为一次性无菌用品,供一次性使用

阳性结果 阴性结果 加样排气泡
水质大肠菌群检验纸片使用说明(十五管法)
1 适用范围:适用于水源水中总大肠菌群的快速检验。
2 方法原理:将乳糖、显色剂和选择性培养基加载在纸片上,经培养后能够在纸片上生长并发酵乳糖产酸的即为大肠菌群阳性,记录每个稀释度大肠菌群阳性纸片数,根据大肠菌群MPN表查出相应的大肠菌群数。

3 操作方法
3.1 用灭菌吸管吸取10mL水样插入装有大纸片的塑料薄膜袋中,均匀涂布,共做5个重复;分别取1mL水样加到小纸片中,共接5个重复;另取1mL水样加到9mL无菌水中混匀,用1mL灭菌吸管分别吸取1mL(即0.1mL水样),加到最后5片小纸片中。
3.2将接种好的纸片平放于培养箱中,36℃±1℃,培养15~24h观察结果。
3.3 观察每片颜色变化,若纸片保持紫蓝色不变为大肠菌群阴性,纸片变黄或在黄色背景上呈现红色斑点或片状红晕为阳性。
3.4 根据每个稀释度的阳性反应纸片数,查MPN表(表3)可得出水样中总大肠菌群的MPN值。
3.5 对于阳性纸片,应进一步检验大肠埃希氏菌或耐热大肠菌群。用无菌镊子在阳性菌斑处挑取少许带菌滤纸,用3mL无菌水混匀,接种到大肠埃希氏菌耐热大肠菌群测试片上,进行44.5℃培养和检验。
菌落总数测试片使用说明
1 原理及适用范围:菌落总数是指样品经过处理,在一定条件下培养后所得1mL(g)检样或单位面积样品中所含菌落的总数,是最常用的检测项目指标。菌落总数测试片(Aerobic Count Plates BB202)是一种预先制备好的一次性培养基产品,含有标准的营养培养基,冷水可溶性的吸水凝胶和脱氢酶指示剂——氯化三苯基四氮唑(TTC),菌落在测试片上呈紫红色或粉红色,这样可缩短计数时间和增强计数效果。本产品适合于食品及水中菌落总数的测定,也可用于与食品接触的容器操作台和其他设备表面的卫生检测。
2 样品处理与稀释
2.1 生活饮用水:取充分混匀的水样(原液)检测。
2.2 水源水:以无菌操作方法吸取1mL充分混匀的水样,注入含有9mL灭菌生理盐水的试管内,混匀成1:10稀释液。用1mL灭菌吸管吸取1:10稀释液1mL,注入含有9mL灭菌生理盐水的试管内,振摇后成为1:100的稀释液,以此类推,做出1:1000等稀释度的稀释液,每次换一支吸管。
2.3 食品:取样品 25 mL(g)放入含有225 mL灭菌生理盐水的取样罐或均质杯内,充分混匀成1:10稀释液。用1mL灭菌吸管吸取1:10稀释液1mL,注入含有9mL灭菌生理盐水的试管内,振摇后成为1:100的稀释液,以此类推,做出1:1000等稀释度的稀释液,每次换一支吸管。
3 接种:将菌落总数测试片(BB202)置于实验台面,揭开上层膜准备接种。生活饮用水、纯水和矿泉水取原液,每个样品做两片;水源水以及食品选择2~3个稀释度进行检测,每个稀释度同时应做一平行接种。以无菌操作方法用灭菌吸管吸取1mL混匀的样品液,慢慢均匀地滴加到测试片上,然后再将上层膜缓慢盖下,静置5 min使培养基凝固,最后用手轻轻地压一下。每次检测,同时将1mL灭菌生理盐水滴加到另一片测试片上作为空白对照。
4 培养: 将测试片叠在一起放回原自封袋中,透明面朝上水平置于恒温培养箱内,堆叠片数不超过12片。培养温度为36℃±1℃,培养15~24h观察结果。

5 结果判读: 细菌在测试片上生长后会显示红色斑点,选择菌落数适中(10~100个)的测试片进行计数,乘以稀释倍数后即为每毫升(克)样品中所含的细菌菌落总数。作菌落计数时,可用眼睛直接观察,必要时用放大镜检查,以防遗漏。在记下各测试片菌落数后,应求出同稀释度的平均菌落数,供下一步计算时用。
6 计数原则及报告方式
6.1通常选择菌落在10~100个之间的测试片进行计数,乘以稀释倍数报告之(见表1实例1)。
6.2若有两个稀释度的菌落数在10~100个之内,两者的比值小于2,则取其平均数,若大于2,则用值小者(见表1实例2、例3)。
6.3若三个稀释度的菌落数都有在10~100个之内,应选择二个低数值的平均数(见表1实例4)。
6.4若三个稀释度的菌落数均小于10个或大于100个时,应重新试用更低或更高的稀释度进行菌落计数;或采用均小于数量标准的最小值,或采用均大于数量标准的最大值(见表1实例5、例6)。
6.5若所有稀释度的测试片均无生长,以未检出报告之。菌落数在100以内时按实有数报告,大于100时,采样两位有效数字,在两位有效数字后面的数值,以四舍五入方法计算,为了缩短数字后面的零数也可用10的指数来表示。

泰亚赛福作为众多知名品牌的合作伙伴,优惠的价格+完善的售后服务体系向您提供产品。font>
技术文档:

泰亚赛福作为众多知名品牌的合作伙伴,优惠的价格+完善的售后服务体系向您提供产品。font>
- 在线浏览:
- 文档下载:

泰亚赛福作为众多知名品牌的合作伙伴,优惠的价格+完善的售后服务体系向您提供产品。font>
相关产品:

泰亚赛福作为众多知名品牌的合作伙伴,优惠的价格+完善的售后服务体系向您提供产品。font>
 LHS16-A卤素水份测定仪订货号:MM-14329-00
LHS16-A卤素水份测定仪订货号:MM-14329-00 DHS20-A红外水份测定仪订货号:MM-14330-00
DHS20-A红外水份测定仪订货号:MM-14330-00 DHS16-A红外水份测定仪订货号:MM-14331-00
DHS16-A红外水份测定仪订货号:MM-14331-00 六价铬测定仪CAC-S51订货号:MM-13993-00
六价铬测定仪CAC-S51订货号:MM-13993-00 亚硝酸盐氨测定仪CAC-S52订货号:MM-13994-00
亚硝酸盐氨测定仪CAC-S52订货号:MM-13994-00 WQC-22A水质检测仪订货号:MM-34021-00
WQC-22A水质检测仪订货号:MM-34021-00 水质理化检验箱订货号:MM-34022-00
水质理化检验箱订货号:MM-34022-00 总硬度测试条订货号:MM-34023-00
总硬度测试条订货号:MM-34023-00 DPM-NO3-N水质检测仪订货号:MM-34017-00
DPM-NO3-N水质检测仪订货号:MM-34017-00 DPM-O3单项目水质检测仪订货号:MM-34018-00
DPM-O3单项目水质检测仪订货号:MM-34018-00 DPM-NO3单项目检测仪订货号:MM-34019-00
DPM-NO3单项目检测仪订货号:MM-34019-00 水质浊度速测盒订货号:MM-15650-00
水质浊度速测盒订货号:MM-15650-00

泰亚赛福作为众多知名品牌的合作伙伴,优惠的价格+完善的售后服务体系向您提供产品。font>
明细价格:

泰亚赛福作为众多知名品牌的合作伙伴,优惠的价格+完善的售后服务体系向您提供产品。font>
| 定货号 | 产品名称 | 规格配置 / 简介 | 市场价/(会员价) |
|---|---|---|---|
| MM-15649-00 | 游泳池水质微生物采样检测箱 | /() |

泰亚赛福作为众多知名品牌的合作伙伴,优惠的价格+完善的售后服务体系向您提供产品。font>
购买流程:

泰亚赛福作为众多知名品牌的合作伙伴,优惠的价格+完善的售后服务体系向您提供产品。font>
①购买产品:点击“生成订单”→填写产品数量、联系方式并提交→会员顾问订单处理→合同签订。
②咨询产品:请联系会员顾问或致电会员客服电话。
③如果您还不是我们的会员,请先注册。
④最小起订数量:1
注意:本产品唯一个人现金委托收款人,如汇入其它个人账户本公司不承担任何责任
维护担当:
上线时间:
投诉电话:13801126385 13911302309
②咨询产品:请联系会员顾问或致电会员客服电话。
③如果您还不是我们的会员,请先注册。
④最小起订数量:1
注意:本产品唯一个人现金委托收款人,如汇入其它个人账户本公司不承担任何责任
维护担当:
上线时间:
投诉电话:13801126385 13911302309
联系方式
电话北京:400-000-1836 分机 / 274 / 828 或拨0转总机
上海:021-54248686 分机 或拨0转总机
上海:021-54248686 分机 或拨0转总机
传真北京:010-84852750/84854139
上海:021-64418200
上海:021-64418200

泰亚赛福作为众多知名品牌的合作伙伴,优惠的价格+完善的售后服务体系向您提供产品。font>
品牌简介
北京泰亚赛福科技发展有限责任公司成立于1999年3月,总部设在北京,位于世界500强企业云集的北京经济技术开发区核心地带,是一家以精密检测仪器为主营业务的大型工贸企业。公…北京泰亚赛福科技发展有限责任公司成立于1999年3月,总部设在北京,位于世界500强企业云集的北京经济技术开发区核心地带,是一家以精密检测仪器为主营业务的大型工贸企业。公司一直致力于为客户提供优质的检测技术解决方案,凭借公司锐意进取、求实创新的奉献精神,现已成长为行业领军企业。随着公司业务的稳步发展,公司规模也在日益壮大,以北京总部为基地,先后在香港、上海、广州、成都、美国、德国、日本成立分公司和办事处,销售网络、服务网络日臻完善和成熟,覆盖了全国各省会城市和地区。
您最近浏览的商品












 中国华夏科创
中国华夏科创



